Agência FAPESP, em 12/05/15
Karina Toledo | Agência FAPESP – Em busca de um novo fármaco para o tratamento da doença de Chagas, pesquisadores do Laboratório Nacional de Biociências (LNBio), em Campinas, têm se dedicado a estudar uma enzima conhecida como glicose-6-fosfato desidrogenase (G6PDH) – essencial para a sobrevivência do parasita Trypanosoma cruzi no organismo humano.
Pesquisadores do LNBio identificam compostos capazes de inibir uma enzima essencial para a sobrevivência do parasita Trypanosoma cruzi. Trabalho ganhou prêmio da Associação Britânica de Cristalografia (divulgação)
Durante o doutorado de Gustavo Fernando Mercaldi, foram identificados ao menos 10 compostos químicos capazes de inibir a ação da enzima e matar o parasita com eficiência comparável à da principal droga hoje usada na clínica: o benzonidazol. A pesquisa contou com Bolsa da FAPESP e foi orientada pelo pesquisador Artur Torres Cordeiro, do LNBio.
Mercaldi tenta agora – durante estágio que realiza na Universidade de Dundee, na Escócia, também com apoio da FAPESP – entender como esses inibidores se ligam à enzima-alvo e desvendar a estrutura tridimensional do complexo formado por essa ligação.
Os primeiros resultados da investigação, conduzida em Dundee sob a supervisão do professor Willian Hunter, já renderam ao brasileiro a indicação para o prêmio David Blow Memorial, concedido anualmente pela Associação Britânica de Cristalografia (BCA, na sigla em inglês).
“Esses compostos capazes de inibir a ação da G6PDH podem servir de inspiração para o desenvolvimento de uma nova droga antichagásica, mas antes é preciso entender de que forma se ligam à enzima. Se conseguirmos desvendar a estrutura tridimensional, poderemos desenhar moléculas com ação potencializada”, explicou Mercaldi.
No T. cruzi, a G6PDH está envolvida no metabolismo de glicose. Dados da literatura científica indicam que, quando a enzima é inibida, o parasita torna-se mais suscetível a morrer em decorrência do estresse oxidativo – condição em que ocorre um aumento nos níveis de espécies reativas de oxigênio que danificam moléculas importantes para o funcionamento das células.
Em estudos anteriores, Cordeiro havia testado um grupo de inibidores pertencentes à classe dos esteroides. Mas, como esse tipo de substância interfere no equilíbrio hormonal humano, poderia desencadear efeitos colaterais indesejáveis. Por esse motivo, durante o doutorado de Mercaldi, o grupo decidiu realizar uma triagem de compostos pertencentes a outras classes químicas.
Por um método conhecido como high throughput screening (triagem automatizada em larga escala), os pesquisadores testaram in vitro – colocando apenas a enzima e o candidato a inibidor para interagir – cerca de 30 mil compostos. Os mais promissores foram testados em culturas do parasita. Foram selecionadas 32 moléculas pertencentes a duas classes químicas: tienopiridinas e quinazolinonas.
“Cerca de 10 dessas moléculas, em especial entre a quinazolinonas, mostraram atividade equivalente à do benzonidazol, que é o composto de referência para o tratamento da doença de Chagas. O caminho até chegar a um novo fármaco ainda será longo, mas comprovamos que é possível matar o parasita ao inibir a enzima G6PDH”, avaliou Mercaldi.
Desvendando a estrutura
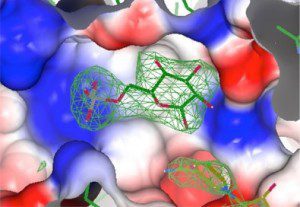
O passo seguinte é descrever a estrutura do complexo formado pela enzima e cada um dos inibidores candidatos, bem como determinar em que local da proteína esses compostos se ligam.
“O problema é que a G6PDH é uma proteína difícil de estudar. Há uma certa dificuldade experimental para se obter cristais pelo fato de ela ser muito flexível. Existem algumas regiões que formam alças totalmente móveis e isso resulta em mudanças conformacionais”, explicou Mercaldi.
Graças a um novo método desenvolvido pelo grupo em Dundee, foi possível obter pela primeira vez o cristal da G6PDH de T. cruziem complexo ternário formado pela enzima, seu substrato (glicose-6-fosfato que será oxidado pela enzima para formar o produto da reação) e seu cofator (outra molécula orgânica não proteica capaz de se ligar à enzima).
“Uma das estratégias que usamos foi tirar algumas regiões da proteína para ela ficar mais estável e aumentar a probabilidade de cristalização. Ainda não conseguimos alcançar nossa principal meta, que é obter o cristal da enzima com os inibidores. Mas mostramos pela primeira vez tanto o substrato como o cofator ocupando ao mesmo tempo os seus respectivos sítios de ligação na molécula de G6PDH. Nas pesquisas feitas com enzimas de eucariontes, foi a estrutura com maior resolução já obtida e, assim, um maior nível de detalhes sobre a G6PDH pode ser desvendado”, disse Mercaldi.
Reconhecimento
O pôster descrevendo os resultados foi selecionado durante a BCA Spring Meeting, realizada entre fim de março e início de abril de 2015. Mercaldi será o primeiro pesquisador brasileiro a gravar seu nome no troféu Blue John Crystal.
“O ganhador deve trazer o troféu até a sua instituição de vínculo – no meu caso LNBio e Unicamp no Brasil, bem como a Universidade de Dundee na Escócia – para gravar o nome. No ano seguinte, deve passar o troféu ao novo vencedor”, explicou Mercaldi.
O primeiro grupo a gravar o nome no Blue John Crystal, em 1988, contou com a participação do inglês Richard Charles Garratt, professor da Universidade de São Paulo (USP) e um dos precursores da cristalografia de proteínas no Brasil.
Repercussão: Farol Comunitário; Planeta Universitário; Unifesp; São Carlos; Rede Notícia; Bonde